A. Tujuan
- Mengetahui perubahan bilangan oksidasi mangan berdasarkan perubahan warna pada reaksi antara permanganate, NaOH dan glukosa.
- Mengetahui pengaruh variasi dari volume permanganate, NaOH dan glukosa yang digunakan.
B. Landasan Teori
Reaksi kimia adalah proses berubahnya pereaksi menjadi produk. Reaksi dapat berlangsung cepat maupun lambat. Pembahasan mengenai kecepatan reaksi (laju reaksi) disebut kinetika kimia atau kinetika reaksi (Syukri, 1999). Kinetika kimia adalah suatu ilmu yang membahas tentan laju (kecepatan) dan mekanisme reaksi (Stroker, 1993). Mekanisme reaksi adalah serangkaian tahapan yang terjadi berturut-turut selama proses perubahan reaktan menjadi produk (Partanan, 2003).
Laju reaksi suatu reaksi kimia dinyatakan sebagai fungsi konsentrai zat pereaksi yang berperan serta dalam reaksi dalam satuan waktu (Hiskia, 1992). Kecepatan reaksi berbanding lurus dengan konsentrasi atau tekanan dari produk atau reaktan terhadap waktu (Stroker, 1993). Laju suatu reaksi dapat ditentukan dengan cara mengikuti perubahan sifat selama terjadi reaksi yaitu dengan menganalisis campuran reaksi dalam selang waktu tertentu (Ahmad, 1992).
Kalium permanganate (KMnO4) merupakan garam yang mengandung ion K+ dan MnO4– (Fatimah, 2018). Senyawa ini merupakan senyawa yang berperan sebagai oksidator yang kuat. Kalium permanganat merupakan alkali yang akan terdisosiasi dalam air membentuk ion permanganat dan juga mangan oksida bersamaan dengan terbentuknya molekul oksigen elemental, sehingga senyawa ini berperan sebagai oksidator. Kalium Permanganat wujudnya berupa kristal yang berwarna ungu kehitaman, berbau, dapat larut dalam air, memiliki titik lebur 1500C, dan berat molekulnya 158.03 gram/mol (Indang et al. 2009).
Mangan (Mn) dalam keadaan murni berwarna putih seperti perak dan mudah teroksidasi oleh udara, bereaksi lambat dengan dan membentuk berbagai macam senyawa dengan tingkat oksidasi yang bervariasi yaitu dari +2 hingga +7 (Sugiyarto, dkk, 2010). Ion mangan (III) tidak stabil, tetapi ada kompleks yang mengandung mangan dalam keadaan oksidasi +3. Mudah direduksi menjadi mangan (II). Mangan (IV) oksida stabil dalam larutan basa dan berwarna hijau. Pada penetralannya terjadi reaksi disproporsionasi, terbentuk endapan mangan dioksida dan ion manganat (VII) atau permanganate. Jika mangan (IV) oksida diolah dengan asam, terbentuk ion-ion mangan (II). Senyawa mangan (VII) mengandung ion MnO4–. Permanganate alkali adalah senyawa stabil yang menghasilkan larutan warna lembayung. Semuanya merupakan zat pengoksidasi kuat ( Shevla, 1990: 135).
C. Alat dan Bahan
Alat:
- Tabung vial
- Pipet Volume
- Ball Pipet
- Senter
- Neraca Analitik
- Spatula
- Kaca Arloji
- Gelas Kimia
- Labu ukur
- Corong
- Pengaduk
Bahan:
- Larutan Glukosa
- Larutan NaOH
- Larutan KMnO4
- Aquades
D. Cara Kerja
- Membuat larutan NaOH 1M sebanyak 100 mL, dengan cara menimbang 0,4 gram padatan NaOH dilarutkan dalam 50 mL aquades, diaduk hingga larut dan dimasukan dalam labu takar 100 mL, lalu tambahkan aquades sampai tanda batas serta homogenkan.
- Membuat larutan glukosa 1M sebanyak 100 mL, dengan menimbang padatan glukosa sebanyak 9,9085 gram dilarutkan dalam 50 mL aquades, diaduk hingga larut dan dimasukan dalam labu takar 100 mL, lalu tambahkan aquades sampai tanda batas serta homogenkan.
- Membuat larutan KMnO4 1M sebanyak 100 mL, dengan cara menimbang 15,8 gram padatan KMnO4 dilarutkan dalam 50 mL aquades, diaduk hingga larut dan dimasukan dalam labu takar 100 mL, lalu tambahkan aquades sampai tanda batas serta homogenkan.
- Dilakukan variasi terhadap volume glukosa, NaOH, dan KMnO4 masing-masing sebanyak tiga variasi.
- Untuk variasi volume KMnO4 dilakukan dengan mencampurkan larutan NaOH dan glukosa dengan masing-masing volume 5 mL dalam tiga wadah.
- Ditambahkan larutan KMnO4 dalam masing-masing wadah sebanyak 2 mL, 4 mL, 6 mL dan amati perubahan warna yang terjadi.
- Ulangi perlakuan tersebut dengan variasi NaOH dan Glukosa masing-masing sebanyak 2 mL, 4 mL, dan 6 mL.
- Amati perubahan warna dan kecepatan waktu untuk perubahan warna.
E. Data Pengamatan
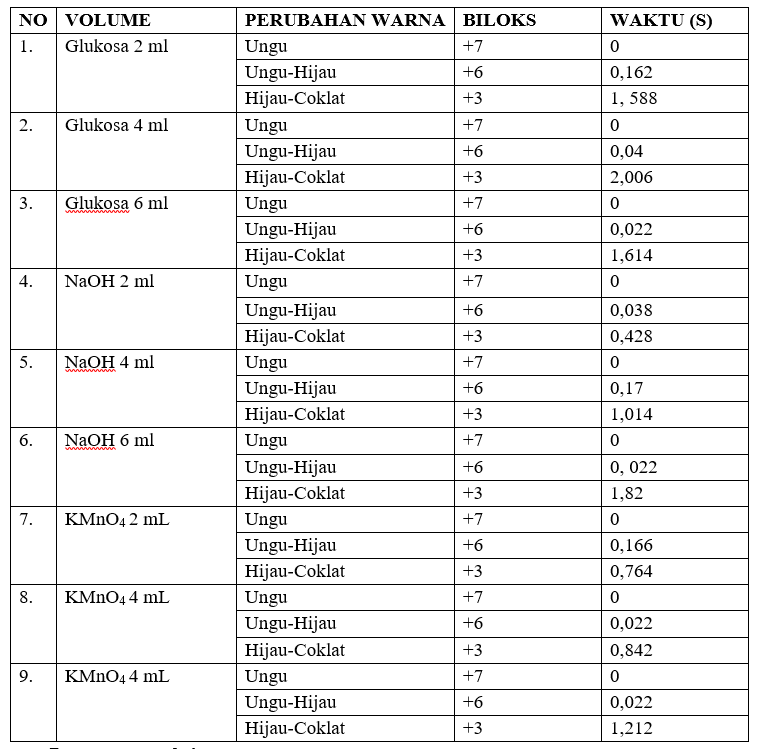
- Persamaan reaksi:
a) Pembuatan Mangan (VI) dalam basa
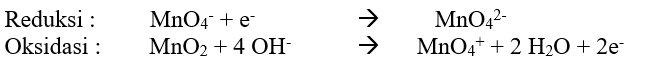
Agar jumlah elektron sama, maka reaksi reduksi dikali 2 dan reaksi oksidasi tetap.
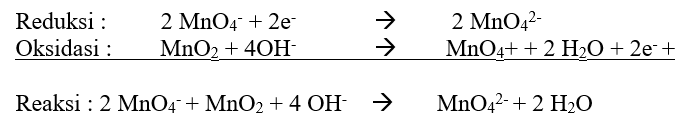
b) Pembuatan Mangan (III)
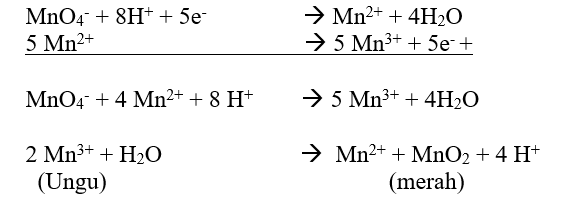
- Perhitungan
a) Mangan (VI) dalam basa
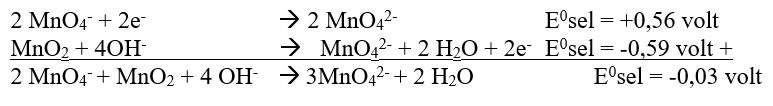
b) Mangan (III)
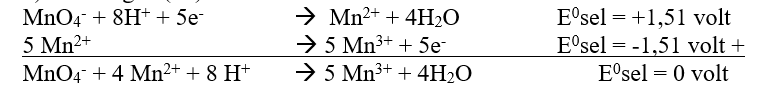
F. Pembahasan
Kinetika reaksi adalah proses elektrokimia yang melibatkan proses reduksi dan oksidasi. Kecepatan atau lajunya berbeda-beda bergantung dari sifat bahan dan faktor lingkungan. Kinetika dilakukan untuk mengetahui kecepatan reaksi yang dilakukan dan ecepatan reaksi ini ditentukan dari terbentuknya produk.
Praktikum kinetika mangan ini dilakukan dengan mengamati perubahan warna yang terjadi pada larutan setelah ditetesi dengan KMnO4. Pengamatan perubahan warna yang terjadi menerapkan prinsip laju reaksi untuk mengetahui perubahan bilangan oksidasi pada ion MnO4–. Praktikum ini dilakukan dengan cara meneteskan larutan KMnO4 pada campuran larutan glukosa dengan NaOH. Larutan yang digunakan divariasikan untuk mengetahui variasi mana yang memiliki kecepatan laju reaksi lebih tinggi. Larutan glukosa berfungsi sebagai reduktor yang akan mereduksi KMnO4 dan NaOH untuk menjaga kesetimbangan ion kromat dan dikromat. KMnO4 berperan sebagai oksidator yang akan mengoksidasi glukosa sehingga mengalami reaksi redoks. Ketika campuran larutan glukosa dengan NaOH ditetesi larutan KMnO4 terjadi perubahan warna dari MnO4– (ungu) menjadi MnO42- (hijau kebiruan), lalu menjadi Mn3+ (coklat kegelapan).
Reaksi yang terjadi:
NaOH + C6H12O6 + KMnO4 → MnO2 + C6H11O7Na + H2O + KOH
Berdasarkan percobaan yang dilakukan, semakin banyak volume glukosa yang ditambahkan maka waktu yang dibutuhkan untuk terjadi perubahan warna semakin sedikit. Seperti pada penambahan glukosa 2 ml dan 4 ml, terutama pada biloks +6 dan +3. Kemudian semakin banyak volume NaOH yang ditambahkan semakin lama waktu yang dibutuhkan untuk terjadi perubahan warna. Hal ini dapat dilihat pada tabel dengan penambahan NaOH 2 ml, 4 ml, dan 6 ml. Ketiga perubahan biloks membutuhkan waktu yang lama untuk terjadi perubahan warna. Kemudian variasi KMnO4, semakin banyak volume KMnO4 yang ditambahkan maka semakin banyak waktu yang dibutuhkan untuk terjadi perubahan warna seperti yang ditunjukkan tabel penambahan KMnO4 2 ml dan 4 ml. Serta dapat dilihat semakin banyak glukosa yang ditambahkan, semakin sedikit waktu yang dibutuhkan untuk terjadi perubahan warna dan semakin banyak NaOH yang ditambahkan maka semakin sedikit waktu yang dibutuhkan untuk terjadi perubahan warna.
G. Kesimpulan
- Perubahan bilangan oksidasi untuk warna ungu +7, warna ungu ke hijau bilangan oksidasi +6 dan dari warna hijau ke coklat bilangan oksidasi +3.
- Semakin banyak volume glukosa yang ditambahkan, waktu yang dibutuhkan untuk terjadi perubahan warna semakin sedikit. Semakin banyak volume NaOH dan KMnO4 yang ditambahkan, semakin lama waktu yang dibutuhkan untuk gterjadi perubahan warna.
H. Daftar Pustaka
Ahmad. 1992. Kinetika Kimia. Jakarta : PT. Rineka cipta.
Fatimah, Ahmad. S, Waluyo. 2018. Laju Reaksi. Yogyakarta : Rineka Cipta
Hiskia, Achmad. 1992. Kimia Larutan. Bandung: PT Citra Aditya Bakti.
Indang N.M., Abdulamir A.S., Bakar A.A., Salleh A.B., Lee Y.H., dan Azah N.Y. 2009. Areriew: Methodes of determination ofhealth-endangering Formaldehyde indiet. Madwell J. 2:31-47.
Shevla, G. 1990. Analisis Organik Kualitatif Makro dan Semimikro. Jakarta: PT Kalman Media Pustaka.
Stoker, H.S. 1993. Introduction to chemical Principle. New York: Macmillan Publishing Company.
Sugiyarto, K.H dan Retno D.S. 2010. Kimia Anorganik Logam. Yogyakarta: Graha Ilmu. Syukri, 1999. Kimia Dasar Jilid 1. Bandung: ITB.
I. Lampiran

Larutan Glukosa 
Pengambilan larutan NaOH 
Penetesan larutan KMnO4 
Variasi KMnO4 
Variasi NaOH 
Variasi Glukosa
