A. Tujuan
- Dapat mensintesis senyawa kompleks Zink dengan Asam Salisilat
- Mengkarakterisasi senyawa kompleks seng salisilat dengan FTIR, Spektrofotometer UV-VIS, dan Konduktometer
B. Landasan Teori
Senyawa kompleks merupakan jenis senyawa yang molekul atau ionnya dapat membentuk ikatan koordinasi dengan atom logam atau ion. Spesies koordinasi (disebut ligan) memiliki pasangan elektron bebas yang dapat disumbangkan untuk logam atom atau ion lainnya, seperti ion lainnya, seperti ion ammonia atau air, atau negative seperti Cl- atau CN-. Kompleks yang dihasilkan mungkin netral atau mungkin menjadi ion kompleks (Dintith, 2004).
Suatu kompleks akan terbentuk antara suatu kation atau logam dengan beberapa molekul netral atau ion donor elektron. Kation atau logam tersebut berfungsi sebagai ion pusat sedangkan molekul netral atau ion donor elektron berfungsi sebagai ligan. Ikatan kovalen koordinasi dalam senyawa kompleks terjadi karena donor pasangan elektron dari ligan ke dalam orbital kosong ion pusat. Ion pusat tersebut umumnya memiliki orbital d yang belum terisi penuh, sehingga dapat berfungsi sebagai akseptor (Mulyani, dkk, 2009). Zn(II) merupakan contoh logam transisi logam blok d divalen deret pertama yang mempunyai konfigurasi elektron d10. Sifat-sifat logam-logam transisi d adalah kemampuannya membentuk kompleks dengan ligan baik anion maupun molekul netral yang dapat bertindak sebagai donor elektron bebas (Hermawati dkk, 2016).
Ligan adalah spesies yang memiliki atom-atom yang dapat menyumbangkan sepasang elektron pada ion logam pusat pada tempat tertentu dalam lengkung koordinasi. Sehingga, ligan merupakan basa lewis dan ion logam adalah asam lewis. Jika ligan hanya dapat menyumbangkan sepasang elektron (misalnya NH3 melalui atom N) disebut ligan unidentat. Ligan ini mungkin merupakan anion monoatomik (tetapi bukan atom netral) seperti ion halida, anion poliatomik seperti NO2-, molekul sederhana seperti NH3 atau molekul kompleks seperti piridin C5H5N (Petrucci, 1987).
Asam salisat bertindak sebagai ligan dalam sintesis senyawa kompleks Zn Salisilat. Asam salisilat, dikenal juga dengan 2-hydroxy-benzoic acid atau orthohydrobenzoic acid, memiliki struktur kimia C7H6O3. Asam salisilat memiliki pKa 2,97. Asam salisilat dapat diekstraksi dari pohon willow bark, daun wintergreen, spearmint, dan sweet birch. Saat ini asam salisilat telah dapat diproduksi secara sintetik. Bentuk makroskopik asam salisilat berupa bubuk kristal putih dengan rasa manis, tidak berbau, dan stabil pada udara bebas. Bubuk asam salisilat sukar larut dalam air dan lebih mudah larut dalam lemak. Sifat lipofilik asam salisilat membuat efek klinisnya terbatas pada lapisan epidermis (Sulistyaningrum et al, 2012).
Sifat-sifat senyawa kompleks yang meliputi sifat magnetik dan warna senyawa kompleks banyak dipelajari dan diteliti melalui suatu mekanisme reaksi dengan menggunakkan ion-ion logam serta ligan yang berbeda-beda. Senyawa kompleks yang disintesis harus memiliki kestabilan tinggi. Salah satu senyawa kompleks yang stabil adalah senyawa kompleks khelat. Senyawa kompleks ini dibentuk dari ligan khelat, yaitu ligan yang mempunyai lebih dari 1 atom donor pasangan elektron (Sitanggang dan Sugijarto, 2018).
Senyawa kompleks zink salisilat sering digunakan sebagai aktivitas antibakteri yang berasal dari senyawa asam salisilat yang mampu menjadi antibakteri dari golongan Streptococcus spp., Staphylococcus spp., Escherechia coli dan Pseudomonas aeruginosa (Rosso, 2005). Dalam aplikasinya sebagai antibakteri, menurut penelitian dari (Bellotti dan Romagnoli, 2014) zink salisilat dapat digunakan sebagai cat antifouling untuk meningkatkan efesiensinya. Dapat pula digunakan sebagai Pasta salisilat-seng yaitu obat yang ditunjukan untuk menghilangkan masalah yang berhubungan dengan kulit.
C. Alat dan Bahan
- FTIR
- Konduktometri
- Neraca Analitik
- Erlenmeyer
- Gelas Kimia
- Labu Ukur
- Pipet Volume
- Ball Pipet
- Kaca Arloji
- Pengaduk
- Spatula
- Labu Takar
- ZnCl2
- NaHCO3
- Asam Salisilat
- Metanol
- Aquades
D. Cara Kerja
- Sintesis Zn Salisilat
Pertama-tama, larutan (ZnNO3)2 dibuat dengan cara melarutkan 0,9519 gram dalam 50 ml aquades dan larutan NaHCO3 dibuat dengan melarutkan 0,84 gram dalam 50 ml aquades. Kemudian keduanya dicampur sehingga terbentuk padatan ZnCO3. Selanjutnya endapan disaring dengan kertas Whatman 42. Endapan tersebut dicampurkan dengan larutan asam salisilat 0,2 M yang dibuat dengan melarutkan 1,3812 gram asam salisilat dalam metanol hingga 50 ml. Panaskan campuran dalam water bath dan jaga suhu agar konstan 80 C. Diamkan dalam suhu kamar, biarkan hingga mengkristal.
- Karakterisasi
a. Konduktometri
Pengukuran daya hantar listrik dilakukan dengan alat konduktometer. Preparasi sampel dilakukan dengan melarutkan sampel pada pelarut metanol, sehingga diperoleh konsentrasi larutan sampel 20 ppm. Selanjutnya sampel akan diukur daya hantar listriknya yang diakibatkan oleh gerakan gerakan partikel dalam larutan.
b. Spektrofotometer UV-vis
Pengukuran panjang gelombang maksimum dan absorbansi sampel dilakukan dengan alat spektrofotometer uv-vis. Preparasi sampel dilakukan dengan melarutkan sampel dengan pelarut metanol, sehingga diperoleh konsentrasi larutan sampel 20 ppm. Larutan sampel kemudian diukur panjang gelombang maksimum dan absorbansinya dengan memasukkan sampel pada kuvet kemudian diukur menggunakan alat spektrofotometer uv-vis.
c. FTIR
Pengukuran gugus fungsi yang ada pada senyawa kompleks yang dihasilkan dilakukan dengan menggunakan alat FTIR. Preparasi sampel dilakukan dengan mencampur padatan kristal senyawa kompleks dengan KBr pada perbandingan 1:10 kemudian dibuat pelet. Pelet yang dibentuk harus homogen, tipis, dan tidak boleh berlubang untuk menghasilkan hasil pengukuran yang baik.
d. Mikroskop
Bentuk dari kristal senyawa kompleks Zn(II)-salisilat dilihat dengan menggunakan mikroskop optik.
E. Pembahasan
Sintesis Zink(II) dengan ligan salisilat dalam pelarut etanol
Sintesis Zn(II)Salisilat dilakukan dengan mencampurkan endapan ZnCO3 dengan larutan asam salisilat untuk menghasilkan Zn(II)Salisilat. Perlu diingat dalam melarutkan asam salisilat harus menggunakan pelarut nonpolar karena sukar larut dalam air. Pelarut yang dapat digunakan contohnya metanol, etanol, ataupun kloroform. Disini digunakan pelarut metanol dikarenakan metanol kemampuan melarutkannya lebih besar dan mudah menguap. Reaksi yang terjadi sebagai berikut:
Zn(NO3)2(aq) + NaHCO3(aq) → ZnCO3(s) + NaCl(aq) +H2CO3(aq)
ZnCO3(s) + 2H-C6H3-2(OH)COOH(aq) → Zn(C6H4-2(OH)COOH)2(s) + H2O(l) + CO2(g)
Pemanasan campuran ZnCO3 dengan asam salisilat dijaga suhunya pada 80oC agar tidak terjadi kerusakan. Kristal seharusnya akan terbentuk setelah larutan mulai mendingin, tapi campuran yang didinginkan dan didiamkan selama 5 hari tidak kunjung membentuk kristal. Ketika larutan dipindahkan ke wadah lain, sisa larutan yang menempel di dinding mulai mengkristal. Larutan dipanaskan kembali, ditengah pemanasan berlangsung lapisan kristal terbentuk di permukaan larutan, kemudian pemanasan dihentikan. Sehari kemudian larutan berubah menjadi kristal. Hasil akhir didapat 1,9245 gram Zn(II)Salisilat. Hasil ini tidak sesuai dengan perhitungan dimana seharusnya diperoleh massa Zn(II)Salisilat sebesar 1,875 gram. Massa berlebihnya dimungkinkan massa zat pengotor dimana masih terdapat kandungan H2O pada campuran. Senyawa kompleks Zn(II)Salisilat yang terbentuk seharusnya berwarna putih, tapi hasil yang diperoleh dari sintesis yang dilakukan kali ini adalah berupa kristal berwarna putih kemerahan. Hal tersebut dapat disebabkan karena zat-zat pengotor yang mencemari larutan ketika proses sintesis kristal.
Konduktometri
Konduktometri merupakan metode analisis kimia berdasarkan daya hantar listrik suatu larutan, yang bergantung pada konsentrasi dan jenis ion dalam larutan (Hendayana, 1994: 90). Daya hantar molar suatu larutan bergantung pada konsentrasi dan jumlah ion dari senyawa elektrolit. Jumlah muatan atau jumlah ion dari spesies yang terbentuk ketika larutan kompleks dilarutkan dapat diketahui dengan cara membandingkan daya hantar molar kompleks tersebut dengan senyawa ionik sederhana dalam berbagai pelarut yang sesuai dan telah diketahui daya hantar molarnya (Lee, 1994: 197-198).
Prinsip kerja konduktometer adalah bagian konduktor atau yang di celupkan dalam larutan akan menerima rangsang dari suatu ion-ion yang menyentuh permukaan konduktor, lalu hasilnya akan diproses dan dilanjutkan pada outputnya yakni berupa angka . Semakin banyak konsentrasi suatu misel dalam larutan maka semakin besar nilai daya hantarnya karena semakin banyak ion-ion dari larutan yang menyentuh konduktor dan semakin tinggi suhu suatu larutan maka semakin besar nilai daya hantarnya, hal ini karena saat suatu partikel berada pada lingkungan yang suhunya semakin bertambah maka pertikel tersebut secara tidak lansung akan mendapat tambahan energi dari luar dan dari sinilah energi kinetik yang dimiliki suatu partikel semakin tinggi (gerakan molekil semakin cepat).
Karakterisasi ini bertujuan untuk mengetahui apakah senyawa kompleks hasil sintesis termasuk senyawa kompleks molekular ataukah senyawa kompleks ionik. Konduktivitas dari senyawa kompleks dibandingkan dengan pelarut yang digunakan, apabila konduktivitas senyawa kompleks lebih besar dari konduktivitas pelarut maka senyawa kompleks ini termasuk kedalam senyawa kompleks ionik sebaliknya apabila lebih tinggi maka termasuk senyawa kompleks molekuler (Illiya dan Martak, 2011).
Hasil konduktivitas Zn(C6H4-2-(OH)COO)2.H2O pada percobaan ini sebesar 47,9 dengan suhu 30,1 C , sedangkan hasil konduktivitas dari larutan pembanding sebesar 59,2 dengan suhu 98,6 ATC.
Karakterisasi dengan FTIR
Metode spektroskopi FTIR (Fourier Transform Infrared), yaitu metode spektroskopi inframerah yang dilengkapi dengan transformasi Fourier untuk analisis hasil spektrumnya. Metode spektroskopi yang digunakan adalah metode absorpsi, yaitu metode spektroskopi yang didasarkan atas perbedaan penyerapan radiasi inframerah. Absorbsi inframerah oleh suatu materi dapat terjadi jika dipenuhi dua syarat, yaitu kesesuaian antara frekuensi radiasi inframerah dengan frekuensi vibrasional molekul sampel dan perubahan momen dipol selama bervibrasi (Chatwal, 1985).
Spektroskopi FTIR (fourier transform infrared) merupakan salah satu teknik analitik yang sangat baik dalam proses identifikasi struktur molekul suatu senyawa. Komponen utama spektroskopi FTIR adalah interferometer Michelson yang mempunyai fungsi menguraikan (mendispersi) radiasi inframerah menjadi komponen-komponen frekuensi. Penggunaan interferometer Michelson tersebut memberikan keunggulan metode FTIR dibandingkan metode spektroskopi inframerah konvensional maupun metode spektroskopi yang lain. Diantaranya adalah informasi struktur molekul dapat diperoleh secara tepat dan akurat (memiliki resolusi yang tinggi). Keuntungan yang lain dari metode ini adalah dapat digunakan untuk mengidentifikasi sampel dalam berbagai fase (gas, padat atau cair) (Harmita, 2006).
Dari uji FTIR Zink Salisilat pada percobaan yang telah dilakukan diperoleh data grafik sebagai berikut :

Grafik yang telah diperoleh pada percobaan dianalisis berdasarkan bilangan gelombang yang didapat dari literatur, sehingga diperoleh data analisis sebagai berikut :
| Senyawa | Bilangan gelombang berdasarkan percobaan | Keterangan | Bilangan gelombang berdasarkan teori |
| O-H (H2O) | 3242,60 | Melebar | 3200-3600 |
| C=C (aromatik) | 1623,53 | Medium | 1500-1675 |
| C-C (aromatik) | 1464,9 | Tajam | 1487-1467 |
| Vs COO– Vas COO– ∆COO ᵟCOO | 1385,84 1242,37 | Medium | 1385 685 |
| C-OH | 1147,7 | Medium | 1050-1300 |
| C-H (aromatik) | 757,88 876,57 694,46 | Tajam | 690-900 |
| Zn-O | 460,02 526,45 | Tajam | 400-700 |
| C=O | – | – | 1820-1600 |
| C-O | 1030,1 | Tajam | 1000-1300 |
Dari karakterisasi FTIR didapat peak sebanyak 12 buah. Peak pertama terdapat pada vibrasi 3242,60 cm-1 yaitu unsur O-H pada air. Lalu untuk C=C (aromatik) paek terjadi pada vibrabi 1623,53 cm-1, sedangkan C-C (aromatik) terjadi peak pada vibrasi 1464,9 cm-1. Peak 1385,84 cm-1 dan 1242,37 cm-1 merupakan vibrasi untuk Vs COO– Vas COO– ∆COO ᵟCOO. Vibrasi 1147,7 cm-1 terjadi pada peak untuk unsur C-OH. Unsur C-H (aromatik) menghasilkan peak pada vibrasi 757,88 cm-1 ; 876,57 cm-1 ; dan 694,46 cm-1 . Pada vibrasi 460,02 cm-1 dan 526,45 cm-1 terjadu peak untuk unsur Zn-O. Peak terakhir yaitu unsur C-O terjadi pada vibrasi 1030,1 cm-1.
Karakterisasi dengan Spektrofotometer UV-VIS
Prinsip dari spektrofotometer UV-VIS adalah penyerapan sinar ultra violet dan sinar tampak oleh suatu molekul yang dapat menyebabkan terjadinya eksitasi molekul dari tingkat energi dasar ke tingkat energi yang lebih tinggi (Hndayana, 1994). Karakterisasi senyawa kompleks Zn-Salisilat (Zn(C6H4-2-(OH)COO)2.H2O) dengan spektrofotometer uv-vis bertujuan untuk mengetahui panjang gelombang maksimum dari senyawa kompleks yang terbentuk.
Sampel yang digunakan untuk diukur panjang gelombang maksimumnya merupakan senyawa tidak berwarna, sehingga pengukuran dilakukan pada daerah panjang gelombang ultraviolet yaitu antara 200-400 nm. Senyawa yang akan diukur harus larut pada pelarutnya dan tidak mengalami perubahan warna ketika di larutkan. Untuk mengetahui apakah kristal yang terbentuk telah berubah menjadi senyawa kompleks, diukur juga panjang gelombang maksimum untuk asam salisilat. Terbentuknya senyawa kompleks dapat dilihat dari perubahan panjang gelombang maksimum. Senyawa kompleks dapat dikatakan telah terbentuk jika terdapat perubahan panjang gelombang maksimum antara asam salisilat dengan kristal yang terbentuk.
Asam salisilat dapat menyerap radiasi UV karena memiliki gugus kromofor atau ikatan rangkap terkonjugasi dan auksokorm dalam strukturnya. Gugus kromofor adalah ikatan atau gugus fungsi spesifik dalam molekul yang bertanggung jawab atas penyerapan cahaya pada panjang gelombang tertentu. Gugus kromofor pada asam salisilat adalah gugus benzyl (memiliki ikatan rangkap terkonjugasi). Sedangkan gugus auksokorm adalah gugus fungsi dalam suatu molekul yang dapat mempengaruhi absorpsi radiasi gugus kromofor. Jika gugus auksokorm terdelokalisasi ke gugus kromofor , maka intensitas absorbansi akan meningkat dan terjadi pergeseran batokromik atau hipsokromik. Gugus kromofor yang terdapat pada asam mefenamat antara lain gugus -OH (Hidroksi) (Clarke, 2005).
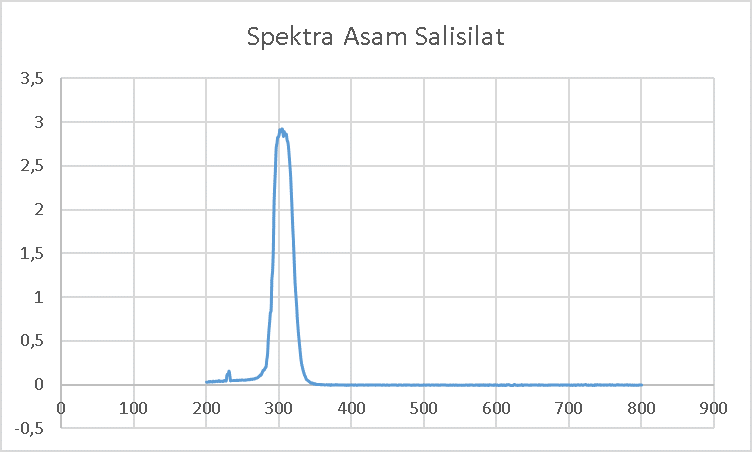
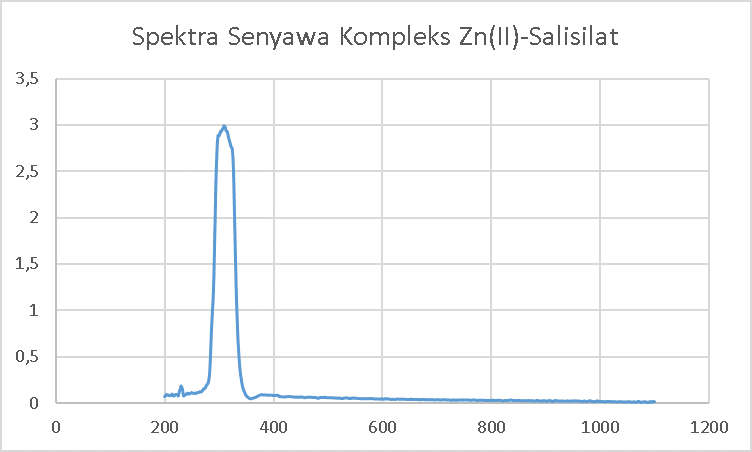
Hasil pengukuran menunjukan jika asam salisilat memiliki panjang gelombang maksimum 302 nm, sedangkan senyawa kompleks Zn-Salisilat memiliki panjang gelombang maksimum pada 309 nm. Terdapat perubahan panjang gelombang maksimum sebesar 7 nm. Senyawa kompleks dapat dikatakan terbentuk jika perbedaan panjang gelombang maksimumnya adalah sebesar 5 nm, sehingga dari pengukuran dengan spektrofotometer UV-VIS dapat disimpulkan jika senyawa kompleks Zn(II)-salisilat telah terbentuk.
Karakterisasi dengan mikroskop

Karakterisasi dengan mikroskop optik berfungsi untuk melihat bentuk kristal senyawa kompleks Zn(II)Salisilat. Dari hasil karakterisasi, dapat dilihat jika bentuk senyawa kompleks Zn(II)Salisilat adalah panjang dan runcing.
F. Simpulan
- Sintesis senyawa kompleks Zn(II)Salisilat dapat dilakukan dengan mencampurkanZnCO3(s) dan 2H-C6H3-2(OH)COOH(aq) sehingga didapat kristal putih.
- Karakterisasi senyawa kompleks Zn(II)Salisilat dilakukan dengan menggunakan FTIR untuk mengetahui gugus fungsinya, spektrofotometer UV-Vis untuk mengetahui panjang gelombang maksimumnya, mikroskop untuk mengetahui bentuk kristal, dan konduktometri untuk mengetahui daya hantar listrik dari senyawa kompleks.
G. Daftar Pustaka
Bellotti, Natalia dan Roberto Romagnoli. 2014. Assessment of Zinc Salicylate as Antifouling Product for Marine Coatings. Industrial & Engineering Chemistry Research. 2(1): 1-24.
Chatwal, G. 1985. Spectroscopy Atomic and Molecule. Bombay:Himalaya Publishing House.
Clarke. 2005. E.G.C. Prof. Clarke’s Analysis of Drugs and poisons. Pharmaceutical Press.
Daintith, J. 2004. The Facts On File Dictionary of Inorgancic Chemistry. New York: Market House Books Ltd.
Hendayana, Sumar. 1994. Kimia Analitik Instrumen. Semarang: Semarang Press.
Harmita. 2006. Analisis Fisika Kimia. Jakarta : Departemen Farmasi FMIPA-UI.
Hermawati, Eka Sulistya, Suhartana, Taslimah. 2016. “Sintesis dan Karakterisasi Senyawa Kompleks Zn(II)-8-Hidroksikuinolin”. Jurnal Kimia Sains dan Aplikasi, 19 (3), 94-98.
Lee, J.D. 1991. Concise Inorganic Chemistry. Fourth Edition. London : Chapmann and Hall.
Mulyani, Nies Suci, Mukhammad Asy’ari, dan Heru Prasetiyoningsih. 2009. “Penentuan Konsentrasi Optimum Oat Spelts Xylan pada Produksi Xilanase pari Aspergillus niger dalam Media PDB (Potato Dextrose Broth)”. Jurnal Kimia Sains dan Aplikasi, 12 (1), 17-13.
Petrucci, H. Ralph dan Suminar. 1987. Kimia Dasar Prinsip dan Terapan Modern. Jakarta: Erlangga.
Rosso, J. Del. 2005. Pharmacotherapy update: current therapies and research for common dermatologic conditions. The Many Roles of Topical Salicyclic Acid. 13: 38-42.
Sitanggang, Stefani Butet dan KH Sugijarto. 2018. “ Sintesis dan Karakterisasi Senyawa Komp[leks Nikel (II) dengan Ligan 1,10-Fenantrokin dan Anion Trifluoromethanasulfonat”. Jurnal Kimia Dasar. Vol 7. No 5.
Sulistyaningrum, Sri Katon, Hanny Nilasari, Evita Halim Effendi. 2012. “Penggunaan Asam Salisilat dalam Dermatologi”. Artikel Pengembangan Pendidikan Keprofesian Berkelanjutan (P2KB). 62 (7) : 277-284.
H. Lampiran

Mencampur larutan (ZnNO3)2 dengan NaHCO3 
Penyaring endapan ZnCO3 
Endapan ZnCO3 dilarutan dalam larutan asam salisilat 
Pemanasan campuran agar terbentuk kristal 
Kristal yang terbentuk 
Penimbangan rendemen kristal 
Karakterisasi dengan konduktometri 
Karakterisasi UV-Vis 
Pembuatan pelet untuk karakterisasi FTIR
